W epoce bardzo szybkiego rozwoju biotechnologii coraz szerszego znaczenia nabiera metoda iniekcji in ovo, pozwalająca na ingerencję w rozwój ptaka jeszcze na etapie jego embriogenezy. Technologia ta opracowana w latach 90-tych XX wieku i do niedawna była kojarzona wyłącznie z dojajowym podawaniem szczepionek, głównie przeciwko chorobom: Mareka, Gumboro, Newcastle i ILT.
Rozwój nauki od zawsze napędzał rozwój przemysłu. Wraz ze wzrostem liczby ludności na świecie rośnie zapotrzebowanie na tanie białko pochodzenia zwierzęcego. Dodatkowo w krajach wysoko rozwiniętych, gdzie zauważa się ogólne podnoszenie się standardów życia i coraz wyższe spożycie białka pochodzenia zwierzęcego, coraz częściej prowadzone są badania nad zwiększeniem wydajności hodowli zwierząt. Cel ten można osiągnąć wieloma sposobami: od metod genetycznego udoskonalania odpowiednim krzyżowaniem ras, poprzez modyfikację sposobów utrzymania, żywienia i suplementacji, aż do biostymulacji szczepionkami i biopreparatami.
W epoce bardzo szybkiego rozwoju biotechnologii coraz szerszego znaczenia nabiera metoda iniekcji in ovo, pozwalająca na ingerencję w rozwój ptaka jeszcze na etapie jego embriogenezy. Technologia ta została opracowana w latach 90-tych XX wieku w USA, początkowo do automatycznego, przemysłowego szczepienia przeciwko chorobie Mareka. Także i do niedawna metoda ta była kojarzona wyłącznie z dojajowym podawaniem szczepionek, głównie przeciwko Chorobom Mareka Gumboro, Newcastle i ILT. Jednak ostatnio, ta relatywnie nowa technika coraz bardziej zyskuje na znaczeniu i zaczyna być stosowana na coraz większą skalę. Szereg badań z ostatnich lat pokazuje, że już można rozważać przemysłowe podawanie preparatów poprawiających odporność i warunkujących prawidłowy wzrost piskląt, a w efekcie końcowy wynik produkcyjny.
Ogólna charakterystyka metody in ovo
Najkrócej mówiąc jest to nic innego jak iniekcyjne podawanie substancji (np. szczepionki) jednak nie wyklutym, jednodniowym pisklętom, ale do jaj z żywym zarodkiem w końcowej fazie klucia, ok. 18 doby. Technika ta polega na wprowadzaniu różnych substancji do samego zarodka lub komory powietrznej zapłodnionego jaja. Początkowo metoda ta szerzej stosowana była podczas szczepienia przeciwko Chorobie Mareka, z czasem jednak in ovo zaczęto wprowadzać inne szczepionki, a także substancje odżywcze czy pożyteczną mikroflorę bakteryjną. Obecnie stosowane in ovo szczepionki pozwalają na uodpornienie piskląt także przeciwko Chorobie Gumboro, Chorobie Newcastle czy Zakaźnemu Zapaleniu Krtani i Tchawicy (ILT). Oprócz szczepionek podaje się in ovo szerokie spektrum innych substancji np. poprawiających skład mikroflory przewodu pokarmowego w pierwszych dniach życia czy antybiotyk stymulujący odporność przeciwbakteryjną. Coraz częściej prowadzone są eksperymenty nad podawaniem tą drogą podstawowych substancji odżywczych, niezmiernie ważnych w pierwszych dobach życia pisklęcia, takich jak aminokwasy, węglowodany czy witaminy.
Metodę in ovo stosuje się także do badań laboratoryjnych nad kancero- i teratogennym wpływem niektórych leków, do badań wpływu hormonów na poszczególne etapy rozwoju zarodkowego, czy określanie płci zarodka na podstawie analizy składu płynu owodniowego.
Sposoby iniekcji in ovo
Iniekcję in ovo można przeprowadzić ręcznie wprowadzając dojajowo odpowiednie substancje. Jest to pracochłonne i przebiega w kilku etapach (dezynfekcja jaja, nawiercenie skorupy, wstrzyknięcie odpowiedniej substancji i zamknięcie otwory w skorupie woskiem lub preparatem o podobnych właściwościach). Ze względu na nakład pracy i czasochłonność metoda ręczna w zasadzie ma zastosowanie jedynie podczas badań i testów laboratoryjnych.
Drugi sposób iniekcji in ovo pozwalający na przemysłowe zastosowanie metody in ovo polega na wykorzystaniu w pełni zautomatyzowanej maszyny. Aktualnie na świecie jest trzech wiodących producentów takich maszyn (Embrex, Viscon-Vinovo i Ecat), jednak procedura samej iniekcji jest bardzo podobna dla nich wszystkich.
W pierwszej fazie jajo jest automatycznie lokalizowane, odpowiednio ustawiane i dezynfekowane, a automat wybiera miejsce iniekcji. Następnie skorupa jest nakłuwana pierwszą, zewnętrzną igłą, zaś igła wewnętrzna deponuje substancję na odpowiednią głębokość do wnętrza jaja. Na koniec otwór po iniekcji jest zasklepiany chemicznie, a igły są ponownie dezynfekowane.
Na szczególną uwagę zasługuje odpowiednia selekcja jaj, tak aby były one mniej więcej jednakowej wielkości. Wiąże się to z odpowiednim zaprogramowaniem głębokości iniekcji i zastosowanie odpowiednich igieł. Igły zbyt krótkie (np. 11mm nie deponują substancji w odpowiednim miejscu), zaś igły zbyt długie (24mm mogą powodować uszkodzenie zarodków). Najbardziej uniwersalne igły o długości ok. 13mm pozwalają na skuteczną iniekcję substancji wystarczająco blisko embrionu, jednocześnie powodując relatywnie najmniej uszkodzeń.
W obecnej, udoskonalonej generacji aparatów do szczepienia in ovo zastosowano technologie podwójnego ciśnienia deponowania, który umożliwia indywidualną adaptację głębokości iniekcji do każdego jaja, niezależnie od rozmiaru. System ten precyzyjnie podaje taką samą dawkę substancji, w to samo miejsce i w tym samym czasie. Wszystkie części stykające się ze skorupą, jak również same jaja oraz igły są dezynfekowanie po każdym wstrzyknięciu.
Jaja niezapłodnione, zepsute lub zawierające zamarle zarodki są usuwane jeszcze przed szczepieniem.
Miejsce i czas iniekcji in ovo
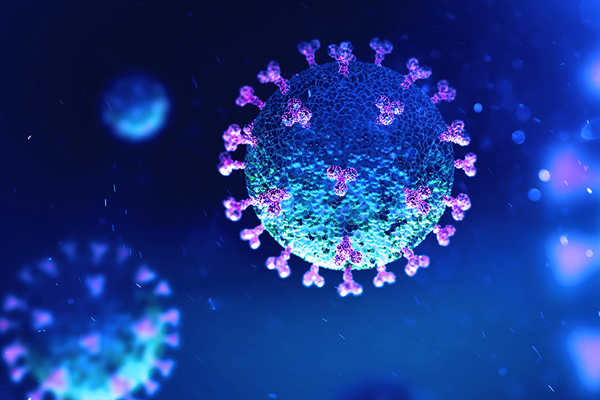
Wiek zarodka i miejsce iniekcji mają ze sobą ścisły związek, a ich dobór zależy od oczekiwanych efektów. Jest kilka typowych miejsc, w które można wykonać iniekcję in ovo. Najczęściej jest to komora powietrzna, owodnia, omocznia, woreczek żółtkowy bądź sam zarodek. W tym ostatnim przypadku eksperymentalnie wykonywano iniekcje podskórne, domięśniowe lub dootrzewnowe w 12 dniu inkubacji.
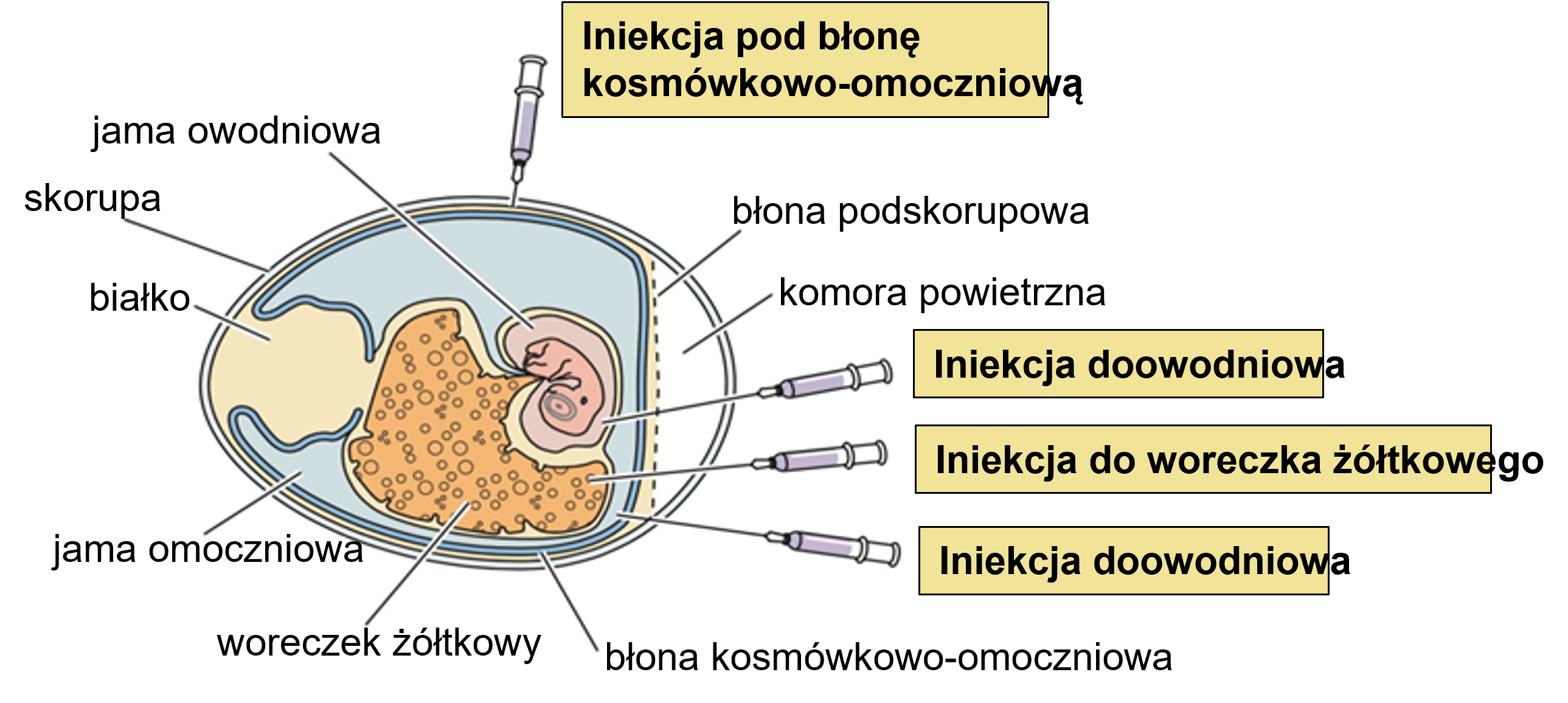
Fig. 1. Miejsce wstrzyknięcia do jaja (na podstawie: V.Racaniello, Virology Lectures 2017)
Ze względu na stosunkowo duże prawdopodobieństwo uszkodzenia zarodka popularność uzyskały jedynie iniekcje do komory powietrznej (w 5 – 12 dniu inkubacji) lub do owodni. Najbardziej powszechna obecnie ze względu na przemysłową możliwość zastosowania w wylęgarniach doowodniowa iniekcja szczepionek ma miejsce podczas przekładu lężonych jaj z komór lęgowych do aparatów klujnikowych w 17-19 dniu inkubacji.
Substancje podawane in ovo
Poprzez zastosowanie metody in ovo można podawać różne substancje poprawiające wylęg, czy stymulujące rozwój pisklęcia w pierwszych, kluczowych dniach życia. Do preparatów podawanych in ovo należą przede wszystkim szczepionki, ale ostatnio coraz częściej podaje się antybiotyki, naturalne stymulatory wzrostu takie jak probiotyki, prebiotyki, a także podstawowe składniki odżywcze jak węglowodany i aminokwasy. Odżywianie in ovo to obecnie dość szeroko stosowana metoda in vivo do oceny potencjalnych efektów prebiotycznych. Otrzymane wyniki z wielu badań pokazują, że karmienie in ovo (przede wszystkim doowodniowe podawanie płynów) jest przydatną i opłacalną pod względem kosztów metodą in vivo do oceny probiotycznych efektów składników odżywczych. Do tej pory wykazano, że zastosowanie w dożywianiu in ovo różnych prebiotyków pochodzenia roślinnego: peptydów, izoflawonów, węglowodanów i synbiotyków zaowocowało in vivo wzrostem efektywności tych związków, przejawiających się poprzez lepsze wchłanianie minerałów, wzrost populacji mikroflory jelitowej i zawartości krótkołańcuchowych kwasów tłuszczowych, lepszy rozwój jelit i stymulację odpowiedzi układu odpornościowego. Nowe badania z wykorzystaniem metody in ovo w dożywiania embrionu prawdopodobnie będą koncentrować się na dalszej identyfikacji składników odżywczych pochodzenia roślinnego i związków bioaktywnych, które mogą poprawić ogólne zdrowie jelit, a w szczególności funkcjonalność powierzchni trawiennej i chłonnej oraz ich wpływ na populacje korzystnych bakterii. Obecne dowody wskazują, że odżywianie in ovo pozwala na badanie jednego składnika lub kombinacji kilku różnych składników odżywczych. Sugeruje to, że metoda dożywiania in ovo jest nową metodą oceny in vivo, która pozwala określić wpływ różnych związków bioaktywne pod względem potencjalnych korzyści żywieniowych.
Probiotyki, czyli żywe kultury bakterii takie jak Lactobacillus acidophillus, Bifidobacterium bifidum, Bacillus sp, Lactococcus sp. czy niektóre gatunki drożdży Saccharomyces. Skuteczność ich zastosowania w 12 dniu inkubacji poprzez iniekcję do komory powietrznej jest wysoka i już w 18 dobie inkubacji w przewodzie pokarmowym zarodka rowijają się bakterie Bifidobacterium i Lactobacillus. Jednoczesne podanie szczepionki in ovo wraz z probiotykiem, w grupie testowej prowadziło w 6 tygodniu życia do zwiększonych poziomów przeciwciał swoistych przeciwko chorobom szczepionym w pierwszym dniu życia metodą aerozolową, między innymi przeciwko Ch. Newcastle i Zakaźnemu Zapaleniu Oskrzeli (IB).
Prebiotyki to składniki pożywienia nie ulegające trawieniu, a pobudzające wzrost lub aktywność korzystnych dla organizmu bakterii obecnych w przewodzie pokarmowym. Możemy do nich zaliczyć polisacharydy (skrobia, inulina, pektyny, guma guarowa) czy oligosacharydy (fruktooligosacharydy FOS, galaktooligosacharydy GOS, maltooligosacharydy MOS). Są one selektywnie trawione przez lacto- i bifidobakterie powodując ich rozwój w przewodzie pokarmowym. Na podstawie niektórych badań, prebiotyki w postaci mieszanek oligosacharydów podane in ovo w 12 dniu inkubacji w znacznym stopniu wpłynęły na rozwój prawidłowej flory przewodu pokarmowego zarodka, dzięki czemu masa piskląt zwiększyła się średnio o 13%, śmiertelność w grupie badanej była o połowę niższa niż w grupie kontrolnej oraz zaobserwowano szybsze wchłanianie się woreczka żółtkowego. W późniejszym okresie życia ptaki, którym podano in ovo prebiotyki wykazywały się bardziej posuniętym rozwojem poszczególnych elementów układu limfatycznego, przez co lepiej reagowały na podane szczepionki i tworzyły wyższe poziomy przeciwciał specyficznych. Z przeprowadzonych badań wynika, że u piskląt brojlerów po iniekcji dojajowej prebiotyków opartych na oligosacharydach rafinozy (ORR) zwiększało się wykorzystanie paszy w późnym okresie tuczu.
Synbiotyki, to reparaty, w których składzie występują obok siebie prebiotyki i probiotyki. U drobiu ich zastosowanie przemysłowe nie jest jeszcze popularne, a ich stosowanie in ovo u ptaków jest jeszcze na etapie badań. W warunkach eksperymentalnych zastosowanie w 12 dniu in ovo do komory powietrznej synbiotyków zawierających szczepy bakterii kwasu mlekowego Lactococcus lactis i Lactococcus cremonis w połączeniu z pochodnymi rafinozy oligosacharydami stymulowało szybszy rozwój elementów układu limfatycznego piskląt, tj. śledziony, grasicy i torby Fabrycjusza.
Aminokwasy to podstawowe składniki budulcowe dla białek i jedne z najważniejszych substancji organicznych w biosferze. Odpowiadają one przede wszystkim za budowę tkanek oraz prawidłowy przebieg funkcji życiowych, w tym także mechanizmy odpornościowe organizmu. Na podstawie wielu badań stwierdzono, że podanie in ovo niektórych aminokwasów poprawia niektóre parametry lęgu. I tak L-arginina podana w 10 dniu inkubacji podniosła odsetek wylęgowości oraz powoduje zwiększenie masy ciała wylęganych piskląt. L-karnityna podana in ovo w 18 dniu inkubacji prowadziła pośrednio do intensywniejszego rozrostu mięśni, zmniejszenia ilości tłuszczu mięśniowego oraz zwiększenia poziomu glikolizy w wątrobie.
Witaminy podawane in ovo stanowią dość dobrze poznane zagadnienie. Badano wielokrotnie podawane tą drogą zarówno witaminy rozpuszczalne w tłuszczach (A, D, E) jak i niektóre rozpuszczalne w wodzie, witaminę C niektóre z grupy B. Witamina C, najbardziej znany przeciwutleniacz ma niebagatelny wpływ na rozwój wielu układów organizmu, w tym układu odpornościowego. Podawanie in ovo witaminy C w dawce 3mg w 15-ej dobie inkubacji skutkowało wzrostem ilości wyklutych piskląt i jednoczesnym zmniejszeniem odsetka piskląt kalekich. Podobne obserwacje poczyniono po podaniu dojajowym witaminy B6 (pirydoksyny), która zmniejszała odsetek zamieralności zarodków, przez co uzyskiwano wyższe parametry wylęgowości. Z kolei niezbędna do prawidłowego rozwoju i funkcjonowania układu nerwowego witamina B1 (tiamina) podana in ovo dawała negatywne skutki w postaci zwiększenia odsetka późnego zamierania zarodków i tym samym obniżenia parametrów wylęgu. Podobne obserwacje wynikały także z badań nad podawaniem in ovo witaminy E. Podawane in ovo w 14 dniu embriogenezy retinol (witamina A), która odpowiada między innymi za rozwój i prawidłowe funkcjonowanie narządu wzroku i skóry oraz cholekalcyferol (witamina D3) odpowiedzialna głównie za rozwój układu kostnego nie wykazały istotnego wpływu zarówno na parametry lęgu, jak i jakość wylęganych piskląt, czy także ich późniejszy rozwój.
Węglowodany podawane w iniekcji dojajowej w założeniach miały poprawić parametry lęgu oraz jakość wylęganych piskląt. Zbadano kilka mieszanek podstawowych węglowodanów (glukoza, fruktoza, dekstryna i maltoza), które podawano w 18 dniu inkubacji bezpośrednio doowodniowo. Wyniki nie były jednoznacznie pomyślne, gdyż o ile wzrosła masa wylęganych piskląt i zmalała objętość woreczka żółtkowego, o tyle zabieg ten obniżył wylęgowość powodując wzrost późnej zamieralności zarodków.
Zastosowanie hormonów w iniekcji in ovo nie wyszło poza fazę eksperymentów laboratoryjnych, prawdopodobnie w związku z zakazem stosowania tych biomodulatorów w przemysłowej hodowli zwierząt. W dotychczasowych badaniach w zasadzie ograniczono się do próby określenia wpływu dwóch hormonów – insuliny i testosteronu – na proces embriogenezy, po ich dojajowej iniekcji. Insulina podana w 1 lub 4 dniu życia zarodka skutkowała jego przyspieszonym rozwojem, wzrostem przeżywalności i masy, jednak nie wpłynęła na poprawę odsetka wylęganych piskląt. Podanie insuliny w 18 dniu embriogenezy nie dawało żadnych zauważalnych efektów. Z kolei po podaniu testosteronu w 15 lub 18 dniu życia zarodka zaobserwowano wzrost masy wylęganych piskląt, ale jedynie płci męskiej. Samice z kolei rodziły się z niższą średnio o 7% masą ciała, a podczas tuczu ich przyrosty dzienne były niższe niż u samic, którym iniekcji testosteronu nie wykonano.
Leki. Ich możliwość zastosowania metodą in ovo wydaje się być oczywistością. Jeśli chodzi o badania eksperymentalne, to podanie środków przeciwzapalnych jak paracetamol czy kwas acetylosalicylowy nie miało większych perspektyw, przede wszystkim na ich niejednoznacznie korzystny wpływ na parametry lęgu i jakość piskląt. Dlatego jedynie podawanie antybiotyków metodą iniekcji dojajowej stwarzało możliwości aplikacyjne, i to na skalę przemysłową. Doomoczniowe podawanie antybiotyków z grupy cefalosporyn w 18 dniu inkubacji wyraźnie hamowało rozwój infekcji bakteryjnych w pierwszym tygodniu życia piskląt. Powszechne i globalne wdrażanie procedur bioasekuracji w przemysłowej produkcji drobiarskiej i postępująca za tym poprawa warunków zoohigienicznych sprawiły, że wydajnie ograniczono wtórne zakażenia powstałe w wylęgarniach, przez co stały się one zagadnieniem drugorzędnym. Dodatkowo presja konsumentów na ograniczanie ilości używanych antybiotyków w produkcji zwierzęcej oraz obawa przed pojawianiem się coraz bardziej opornych na antybiotyki drobnoustrojów, spowodowały praktycznie całkowite odejście od iniekcyjnego podawania antybiotyków zarówno in ovo jak i już po wylęgu jednodniowym pisklętom.
Szczepionki podawane in ovo
Szczepienie in ovo to z jednej strony chyba najbardziej przyszłościowe zagadanienie w dziedzinie bio-manipulacji na zarodku kurzym, a z drugiej strony najbardziej zaawansowane i coraz szerzej stosowane w przemysłowej produkcji drobiarskiej.
Poprzez właściwie dobrany program szczepień profilaktycznych stad rodzicielskich uzyskujemy odporność bierną, determinowaną odpowiednim poziomem przeciwciał matczynych (MDA) przekazywanych potomstwu. Jednakże przeciwciała matczyne (MDA) z jednej strony gwarantujące zabezpieczenie przeciwko wczesnym zakażeniom w pierwszych dniach życia, z drugiej strony hamują powstawanie pełnej odporności po szczepieniu. W wieloletnich badaniach wykazano, że geneza powstawania przeciwciał w organizmie ptaka znacznie różni się od analogicznego procesu u innych gatunków. W przypadku na przykład ssaków, proces reorganizacji genów przeciwciał znany jako somatyczna konwersja genów jest ciągły i trwa całe życie, natomiast u ptaków występuje tylko raz – podczas rozwoju embrionalnego. U pisklęcia macierzyste komórki wytwarzające przeciwciała limfocytów B (ang. Prebursal Stem Cells), powstają między 8 a 14 dniem embriogenezy w pęcherzyku żółtkowym, szpiku kostnym i tkance wątrobowej, a następnie migrują do Torby Fabrycjusza, gdzie podlegają różnicowaniu i klonowaniu.
Proces ten rozpoczyna się około 12 dnia rozwoju embrionalnego i trwa przez kilka następnych tygodni, maksymalne przyspieszenie osiągając w okresie tuż przed wylęgiem do około 2 dni po wykluciu. Między 18 dniem embriogenezy a 2-4 tygodniem życia większość limfocytów B migruje z Torby Fabrycjusza do grasicy i wtórnych narządów limfatycznych, dzięki czemu już 2-4 tygodniowe kurczęta rozwijają bardzo wszechstronną odporność. Między 7 a 13 tygodniem życia kurcząt, Torba Fabrycjusza po spełnieniu swoich funkcji związanych z proliferacją i różnicowaniem limfocytów B zaczyna zanikać.
Dlatego niezależnie od tego, czy szczepienie wykonane jest in ovo około 18 dnia embriogenezy czy tuż po wykluciu, to pozwala na powstanie odporności przeciwzakaźnej jeszcze przed przedostaniem się przeciwciał MDA do krwiobiegu pisklęcia.
W związku z tym, w przemysłowej produkcji drobiu pojawił się trend do opracowania metody skutecznej immunizacji młodych ptaków, która pozwoli na wczesne wytworzenie czynnej odporności. Na początku lat 80-tych XX wieku niektórzy badacze w USA zwrócili uwagę na możliwość wytworzenia odporności czynnej przeciwko Chorobie Mareka już przez 17-19 dniowe embriony kurze. Stało się to podstawą do dalszych prac nad opracowaniem masowej techniki szczepienia w końcowym etapie embriogenezy pisklęcia. Po kilku latach badań skonstruowano i opatentowano pierwszą przemysłową maszynę do szczepienia in ovo. Początkowo była ona stosowana do profilaktyki jedynie Choroby Mareka, ale wkrótce zaobserwowano, że metoda ta z powodzeniem może służyć do zabezpieczenia przeciwko innym chorobom wirusowym, a nawet kokcydiozie. Od samej konstrukcji szczepionki i szybkości uwalniania zawartego w niej antygenu zależy czas pojawienia się odporności czynnej przeciwko różnym chorobom zakaźnym, jak Choroba Mareka, Newcastle, Gumboro, ospa czy ILT.
Jednym z najczęściej wykonywanych techniką in ovo zabiegów profilaktycznych jest szczepienie przeciwko Zakaźnemu Zapaleniu Torby Fabrycjusza (Ch. Gumboro). Przeprowadza się go w 18 dniu inkubacji poprzez iniekcję szczepionki bezpośrednio do worka omoczniowego zarodka. Aktualnie wiele firm szczepionkowych posiada w swojej ofercie różnej generacji szczepionki pozwalające na uzyskanie stosunkowo wczesnej odporności czynnej. Najczęściej stosowane in ovo szczepionki przeciwko Ch. Gumboro to:
- Szczepionki wektorowe – złożone są one z wektora – wirusa HVT (serotyp 3 wirusa Choroby Mareka), do którego wbudowany jest ważny dla odpowiedzi immunologicznej gen białka VP2 wirusa choroby Gumboro. Z uwagi na fakt, że szczepionki te nie zawierają pełnego wirusa, nie zachodzi tu proces kolonizacji Torby Fabrycjusza, przez co wirus szczepionkowy nie sieje się do środowiska kurnika i nie pasażuje przez zaszczepione ptaki. Zatem ptaki pominięte przy iniekcji nie mają możliwości „doszczepienia się” drogą pokarmową od reszty stada i pozostają wrażliwe na zakażenie do końca życia. Ponadto w przypadku szczepionek wektorowych opartych na wirusie HVT jako nośniku odpowiedź immunologiczna choć dobra i długotrwała, to pojawia się stosunkowo późno i narasta powoli, co wynika to z samej właściwości wektora. W praktyce więc pełną odporność przeciwko Chorobie Gumboro brojlery uzyskują około 5-6 tygodnia życia, a więc w zasadzie dopiero w wieku ubojowym.
- Szczepionki immunokompleksowe – produkowane na bazie żywych, atenuowanych wirulentnych szczepów wirusa IBD, które już na etapie produkcji są opłaszczone wyhodowanymi w laboratorium specyficznymi przeciwciałami. Wirus jest uwalniany z tego kompleksu immunologicznego wraz z postępującym naturalnie spadkiem poziomu przeciwciał matczynych (MDA) u piskląt. Uwolniony wirus szczepionkowy podobnie do konwencjonalnych atenuowanych replikuje w Torbie Fabrycjusza i sieje się do środowiska kurnika. Jest to istotne, gdyż nawet pominięte przy iniekcji pisklęta mają możliwość „doszczepienia się” drogą pokarmową od reszty stada i będą w stanie wykształcić odporność.
- Iniekcyjne żywe szczepionki atenuowane – to innowacyjne rozwiązanie firmy Phibro Animal Health na potrzebę uzyskania jeszcze bardziej skutecznej ochrony przeciwko chorobie Gumboro. Nowatorska koncepcja zapobiegania Chorobie Gumboro oparta jest na niekonwencjonalnej, żywej szczepionce atenuowanej Phivax, która jest podawana w wylęgarni metodą iniekcji in ovo w 18 dniu inkubacji lub podskórnie w pierwszym dniu życia. Odpowiednio zmodyfikowany szczep pośredni MB wirusa warunkuje stabilność i bezpieczeństwo szczepionki i podobnie jak konwencjonalne, atenuowane wirusy szczepionkowe replikuje w Torbie Fabrycjusza. Zasiedlenie Torby Fabrycjusza przez wirus szczepionkowy w odpowiednim momencie jest bardzo istotne, gdyż o stanowi skuteczną blokadę przed replikacją wirusów terenowych, w tym szczepów very virulent IBDV. Wirus szczepionkowy MB po dostaniu się do organizmu adaptuje się do aktualnego statusu immunologicznego każdego ptaka indywidualnie replikując w optymalnym czasie, skorelowanym z postępującym spadkiem przeciwciał matczynych (MDA). Nie mamy więc w tym przypadku do czynienia z „okienkiem immunologicznym”, gdyż spadkowi poziomu MDA (początkowo wiążących wirusy szczepionkowe) towarzyszy równoległy wzrost poziomu własnych przeciwciał swoistych, stymulowanych replikacją wirusa szczepionkowego w Torbie Fabrycjusza.
Zalety i wady metody szczepienia in ovo
Podstawową zaletą metody iniekcji in ovo jest możliwość jej masowego zastosowania, przez co znacznie obniża się koszt szczepienia. Jednocześnie w krótkim czasie można zaszczepić dużą ilość piskląt, a automatyzacja całego procesu eliminuje błędy obsługi, ogranicza nakład ręcznej pracy i wykonuje automatyczną selekcję jaj nadających się do dalszej inkubacji. Dezynfekcja na każdym etapie procesu pozwala uzyskać lepszej jakości materiał do tuczu i minimalizuje ryzyko zakażeń wtórnych. Zaszczepienie wyłącznie prawidłowo rozwiniętych embrionów pozwala na wcześniejsze przygotowanie organizmu pisklęcia do wykształcania mechanizmów odporności swoistej oraz uzyskanie lepiej wyrównanych pod względem immunologicznym stad. Dzięki temu jesteśmy w stanie skutecznie ograniczać skutki wczesnych zakażeń wirusami Choroby Mareka, Gumboro czy Newcastle.
Jakość jednodniowych piskląt ma ogromny wpływ na końcowy wynik tuczu. Zdrowe, odpowiednio zaszczepione i w pełni rozwinięte pisklęta charakteryzują się lepszymi przyrostami oraz przeżywalnością. W rezultacie wprowadzenia metody in ovo eliminujemy także stres pisklęcia związany z iniekcyjnym szczepieniem w pierwszym dniu życia, a także skraca się czas dostawy z wylęgarni do fermy.
Metoda in ovo w porównaniu to tradycyjnych szczepień w pierwszym dniu życia wcześniej pobudza układ odpornościowy. Wyniki niektórych badań wykazały obecność pierwszych przeciwciał przeciwko Chorobie Mareka już u 3-dniowych piskląt, natomiast u ptaków szczepionych w pierwszym dniu życia przeciwciała zaczynały się pojawiać w 7 dobie życia. Zastosowanie in ovo szczepionki przeciwko Chorobie Gumboro zabezpiecza stado do końca trwania cyklu produkcyjnego, przy czym szczepionki oparte na pełnym, atenuowanym wirusie indukują skuteczną odporność o 4 dni wcześniej niż równolegle stosowane szczepionki immunokompleksowe. Nie ma zatem potrzeby doszczepienia kurcząt na fermie, przez co oszczędzamy czas, pracę i unikamy problemów związanych z nieprawidłowym zaszczepieniem w kurniku.
Niestety metoda iniekcji in ovo posiada także swoje niedoskonałości, z których podstawową jest wysoki koszt utrzymania sprzętu. Urządzenia in ovo potrafią osiągnąć wydajność szczepienia do osiąga 60 000 jaj na godzinę, dlatego biorąc pod uwagę potrzebę maksymalizacji wydajności urządzenia oraz niemałe gabaryty samych urządzeń jedynie duże zakłady wylęgowe są w stanie pozwolić sobie na utrzymanie urządzeń do szczepień in ovo.
Niemały koszt w utrzymaniu sprzętu stanowi też konieczność zapewnienia wysoko wyspecjalizowanego serwisu, odpowiednich, markowych środków do pielęgnacji i dezynfekcji urządzenia oraz konieczność podniesienia standardów bioasekuracji i higieny w wylęgarni.
Pomimo tych wszystkich niedogodności metoda in ovo zyskuje coraz więcej zwolenników, zaczyna być coraz częściej stosowana, a firmy farmaceutyczne, zwłaszcza te produkujące szczepionki coraz większą uwagę zwracają na rozwój preparatów, które mogą być podawane w iniekcji dojajowej.
Rozwój biotechnologii zwierząt sugeruje kilka nowatorskich kierunków badań, możliwych do zastosowania w technologii in ovo. Aktualnie prowadzone badania nad różnymi preparatami chemicznymi i biologicznymi podawanymi in ovo pozwalają nie tylko na lepsze wykorzystanie potencjału kurcząt w hodowli, w produkcji mięsa i jaj, ale także pozwalają na badania nad ich wpływem na zdrowie i życie ludzi, w tym na badania nad nowej generacji lekami przeciw nowotworowymi. Ale to już temat na inne opracowanie.
Powyższy artykuł został wydany w miesięczniku „Hodowca Drobiu” nr 4/2021
Referencie:
Avakian A, Wakenell P, Bryan T, Schaeffer J, Williams C, Whitfill C. In ovo administration of Marek’s disease vaccine: Importance of vaccine deposition site in the fertile egg, in Proceedings. 51st Western Poultry Disease Conference 2002
Barbosa T, Williams C, Villalobos T. Efficacy and Marek’s disease protection comparison between different vaccination methods, in Proceedings. 18th Congress World Veterinary Poultry Association 2013
Bednarczyk M. Wpływ prebiotyku podanego in ovo na efektywność odchowu kurcząt rzeźnych. Polskie Drobiarstwo 10/2010
Bednarczyk M. Technologia in ovo narzędziem w sterowaniu jakością produkcji drobiarskiej. Polskie Drobiarstwo 9/2010
Bednarczyk M, Brzezińska J, Kasperczyk K, Siwek M, Sławińska A, Urbanowski M. Technologia in ovo narzędziem w nowoczesnej profilaktyce drobiu. Biotechnologia 1/2010
Borzemska W, Szeleszczuk P. Szczepienie in ovo – nową techniką immunizacji drobiu. Medycyna Weterynaryjna 55(1)/1999
Czyszczon W, Krakowiak D, Dados E, Batkowska J. Iniekcja in ovo jako forma biomanipulacji na zarodku ptasim. Wiadomości Drobiarskie 4/2018, 5/2018
Henry M, Burke W. The effects of in ovo administration of testosterone or an antiandrogen on growth of chicken embryos and embryonic muscle characteristic. Poultry Science 78 (7) 1999
Hopkins B, Williams C. Field evaluation of the accuracy of vaccine deposition be two different commercially available in ovo injection systems. Poultry Science 90/2011
Kidd M, Ohta Y, Ishibashi T. Embryo growth and amino acid concentration profiles of broiler breeded eggs, embryos and chick after in ovo administration of amino acids. Poultry Science 80/2001
Pijarska-Bińkowska I. Technika szczepień in ovo w profilaktyce drobiu. Magazyn Weterynaryjny, Dodatek 2010.
Racaniello V. Influenza virus growth in eggs. 2009. www.virology.ws/2009/12/10/influenza-virus-growth-in-eggs/
Urbanowski M. Szczepienia drobiu podawane drogą in ovo . Weterynaria w terenie 1/2010
Williams C. In ovo vaccination and chick quality. International Hatchery Practice 19(2)/2005
Williams C. In ovo vaccination for disease prevention. International Poultry Production 15(8)/2007
Williams C, Zedek A. Comparative field evaluations of in ovo applied technology. Poultry Science 89/2010 :1