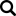Choroby układu oddechowego pozostają wciąż najistotniejszym wyzwaniem w produkcji drobiarskiej. Wszyscy mamy świadomość, jak kluczowe funkcje spełnia w organizmie układ oddechowy. U ptaków układ ten jest wysoce skomplikowany i zapewniający wysoko efektywny system wymiany powietrza. Zdolność ta spowodowała wyjątkową wrażliwość i podatność na choroby, zwłaszcza powodowane czynnikami zakaźnymi. Integralną częścią układu oddechowego u ptaków są worki powietrze umieszczone głęboko wewnątrz organizmu i pozostające w bezpośrednim kontakcie z wieloma innymi narządami, w tym z układem rozrodczym. Dodatkowo brak u ptaków przepony, która rozdziela jamę opłucnej od jamy brzusznej jest dodatkowym czynnikiem sprzyjającym rozwijaniu się infekcji układu oddechowego na pozostałe narządy wewnętrzne [1]. Zatem zdrowy układ oddechowy ma podstawowe znaczenie dla ogólnego stanu zdrowia organizmu i w znacznej mierze decyduje także o wyniku ekonomicznym w przemysłowej produkcji drobiarskiej.
Wraz z intensyfikacją produkcji drobiarskiej wzrasta także ilość patogenów, chorób i innych problemów związanych z prawidłowym funkcjonowaniem układu oddechowego. Straty ekonomiczne związane ze schorzeniami układu oddechowego sprawiają, że zarówno hodowcy jak i lekarze weterynarii oczekują szybkich, prostych i skutecznych rozwiązań. Oczekiwania te kierowane są głównie w stronę firm farmaceutycznych produkujących antybiotyki i szczepionki. O ile antybiotykoterapia jest potencjalnie niebezpieczna dla konsumenta i środowiska, to profilaktyka poprzez szczepienie jest bardziej skuteczna i w dodatku tańsza od leczenia. Dodatkowym czynnikiem napędzającym stosowanie profilaktyki jest ciągle zmieniająca się, nawet lokalnie sytuacja epizootyczna. Dlatego w przemysłowym chowie drobiu rośnie rola coraz to nowszych szczepionek jako specyficznych preparatów skierowanych przeciwko chorobotwórczym patogenom, w tym także powodującym schorzenia układu oddechowego.
Etiologia i patogeneza zakaźnego zapalenia oskrzeli kur
Jednym z podstawowych schorzeń układu oddechowego w drobiarstwie wciąż pozostaje zakaźne zapalenie oskrzeli kur. W regionach nie dotkniętych endemicznie Chorobą Newcastle czy wysoce zjadliwą grypą ptaków, IB jest najbardziej dotkliwą ekonomicznie chorobą w przemysłowej hodowli drobiu [2]. Choroba została opisana po raz pierwszy w USA w latach 30-tych i początkowo była kojarzona jedynie z zakażeniem układu oddechowego. Kilka lat później potwierdzono, że czynnikiem ją wywołującym jest wirus, zaś w latach 50-tych potwierdzono wpływ tego wirusa na parametry produkcji jaj, takie jak okresowe spadki nieśności, spadek jakości skorupy czy spadek wylęgowości [3]. Następnie badacze zaczęli wiązać występowanie tego wirusa z zapaleniem nerek, występowaniem cyst jajowodowych czy szybko rozwijającymi się wtórnymi, bakteryjnymi infekcjami całego układu oddechowego, powodowanymi przez bakterie takie jak Mycoplasma sp., Ornitobacterium rhinotracheale i Escherichia coli [4,5]. Wraz z rozwojem technik diagnostycznych, a zwłaszcza metod biologii molekularnej (PCR) udało się ustalić, że w intensywnej produkcji drobiarskiej mamy do czynienia z wieloma serotypami wirusa IB, a nowy serotyp może pojawić się już wskutek niewielkich nawet zmian w obrębie genomu krążącego wirusa. Zdarza się, że nowe serotypy wykazują dużą różnorodność genetyczną i zmienny tropizm do narządów. Z jednej strony jest ciągły wzrost pogłowia drobiu, sposób jego chowu, poprawianie genetyki ptaków, wymiana handlowa i powszechne stosowanie antybiotykoterapii, częste stosowanie niepełnej profilaktyki lub niewłaściwe podawanie szczepionek (błędy w aplikacji, niepełna dawka). Z drugiej strony biologiczne właściwości wirusa, czyli struktura jego genomu czy brak zdolności naprawczych replikazy wirusowego RNA predysponują do powstawania samoistnych, spontanicznych mutacji (zamiany pojedynczych nukleotydów) czy rekombinacji (wymiany fragmentów genomu) powodując dużą niestabilność genetyczną wirusa IBV [6,7]. Wszystkie te czynniki powodują, że IB pozostaje „ruchomym celem” w programach profilaktyki stad kur, a mnogość wariantów tego wirusa utrudnia zastosowanie skutecznej profilaktyki.
W przypadku IB do zakażenia dochodzi drogą transmisji horyzontalnej (z ptaka na ptaka w obrębie stada lub fermy) poprzez inhalację, kontakt bezpośredni z zakażonymi ptakami, odchodami, ściółką czy zanieczyszczonym sprzętem. W przypadku niedostatecznej bioasekuracji również obsługa fermy, a nawet lekarz weterynarii mogą być wektorem przenoszącym wirusa. Transmisja pionowa (z rodziców na potomstwo nie jest potwierdzona, pomimo że wirus namnaża się w jajowodach niosek i jądrach u kogutów [8]. Jednak wirus wydalany z układu rozrodczego czy pokarmowego nioski może zanieczyszczać powierzchnię skorupy jaja i przez to może być potencjalnym źródłem zakażenia dla piskląt. Wirus powoduje zmiany morfologiczne w jajowodzie przez co jajo podczas tworzenia źle się obraca i następuje nieprawidłowe tworzenie porów w skorupie. Później skutkuje to zaburzeniami w wymianie gazowej zarodka w klujniku prowadząc w efekcie do zamierania zarodka. Zmiany powodowane przez wirusa w warstwie mięśniowej jajowodu powodują częściowe powstawanie blizn, co widoczne jest jako jaja krzywe bądź bruzdowate.
Wśród doniesień naukowych można znaleźć i takie, które metodami PCR potwierdzają obecność IBV w żółtkach jaj wylęgowych [9]. Jednak na podstawie dotychczasowych badań naukowych uważa się, że obecność wirusa IB nie pozwala na rozwój zarodka, gdyż zaburza on rozwój białkowych sznurów chalazowych ustalających pozycję zarodka w jaju, przez co zamiera on w ciągu 96 godzin od zakażenia [10]. Na podstawie prób izolacji z narządów: nerek, śledziony, wątroby i woreczka żółtkowego nie uzyskano naukowego potwierdzenia obecności tych wirusów w embrionach późno zamarłych czy zamarłych w aparatach wylęgowych w wieku powyżej 18 dni. Fakt ten raczej potwierdza, że wirus IB jest śmiertelny dla embrionu we wczesnej fazie rozwoju, zaś wykrycie wirusa w żółtku i przenoszenie wertykalne to dwa niezależne tematy, nawet przypadek pojedynczego wykrycia wirusa IB w jaju nie ma większego klinicznego i epidemiologicznego znaczenia dla problemów z IB późniejszej hodowli kurcząt.
Miejscem, w którym początkowo najintensywniej replikuje IBV tuż po zakażeniu są komórki nabłonkowe górnych dróg oddechowych, a największa ilość wirusa jest wykrywana zwykle 3-5 dni po zakażeniu [11]. Wirus tuż po wiremii pojawia się w narządach, głównie w nerkach, układzie rozrodczym, ale także namnaża się w tkance limfatycznej GALT układu pokarmowego czy torbie Fabrycjusza. To właśnie w układzie pokarmowym (migdałki jelit ślepych) a nie oddechowym IBV jest najdłużej wykrywany – po zakażeniu terenowym pełnego wirusa można izolować nawet do 80 dni, zaś jego materiał genetyczny można wykryć metodą PCR nawet po 5 miesiącach.
Sam genom wirusa zbudowany jest z pojedynczej nici RNA. Większa jego część (około 2/3) koduje wirusową replikazę (enzym polimerazę RNA), która umożliwia namnażanie wirusa po wniknięciu do komórek gospodarza. Pozostała około 1/3 RNA koduje głównie 4 główne białka strukturalne: białko otoczki E (ang. Envelope), białko nukleokapsydu N (ang. nucleocapsid), białko membranowe M oraz białko wypustki S (Spike). Z epidemiologicznego punktu widzenia, a także ze względu na efektywność szczepienia najważniejsza jest glikoproteina S, w której strukturze istotne są 2 regiony, tj. region S2 zakotwiczający wypustkę oraz region S1 który tworzy zewnętrzną jej część i jako pierwszy antygen jest rozpoznawany przez układ immunologiczny ptaka [12]. W związku z faktem, że region ten wykazuje się największą zmiennością, dochodzącą do 50%, przyjmuje się, że właśnie proteina S1 determinuje serotyp wirusa IB.
Patogenność szczepów wirusa IB
Naukowcy bazując na zdobytej wiedzy postanowili stworzyć drzewo filogenetyczne wirusa IB, aby uprościć zrozumienie różnic i podobieństw pomiędzy poszczególnymi serotypami IBV. Aktualnie znanych jest ponad 1000 różnych jego serotypów i trudno je przedstawić w formie graficznej na jednym wykresie, jednakże te o największym znaczeniu ekonomicznym i epizootycznym zostały zamieszczone poniżej.
Zdj. 1 Uproszczone drzewo filogenetyczne Coronaviridae wraz z umiejscowieniem podstawowych terenowych i szczepionkowych serotypów wirusów IB
Dodatkowo w związku ze znaczną zmiennością wirusa IB postanowiono sklasyfikować je w grupy genetyczne od GI do GVI, które łącznie składają się z 32 różnych linii [12]. Najbardziej znany i rozpowszechniony jest genotyp GI, w obrębie, którego jest 27 linii. I tak szczepy wirusa IB, tak jak odkryte najwcześniej Massachusetts występują na całym świecie, w zasadzie w formie niezmienionej od lat należą do GI-1 i tu można wyróżnić zarówno terenowe serotypy oraz znane szczepionkowe jak H120 czy M41. Jednakże w środowisku przez dłuższy lub krótszy okres krążą także inne warianty, które mają różne znaczenie ekonomiczne i epidemiologiczne. Pewne warianty IB dominowały w niektórych krajach w krótszym czasie. To zjawisko dotyczyło w latach 80-tych i 90-tych XX wieku tzw. wariantów holenderskich D1466 i D274 oraz wariantu włoskiego IT-02.
Do serotypów o największym znaczeniu ekonomicznym zalicza się jednak te patogenne, krążące w środowisku przez dłuższy czas. Aktualnie w rejonie Europy są serotypy grupy 793B, należące do genetycznej grupy GI-13 [3]. Ten serotyp został wyizolowany w latach 90-tych XX i na jego bazie powstało kilka komercyjnych szczepionek, między innymi szczepionka Tabic Var, zawierająca wariantowy serotyp 233A.

Zdj. 2 Duszność w przebiegu zakażenia IB
Zdj. 3 Wyraźna nefropatia w zakażeniu IB
Powstanie tej szczepionki było odpowiedzią na obserwowane wówczas na terenie północnej Afryki i Bliskiego Wschodu zakażenia przebiegające z objawami oddechowymi (ryc 2), biegunki, białego wodnistego kału, a w obrazie sekcyjnym dominowały zmiany w obrębie nerek, które były bladoróżowe, obrzękłe z wyraźnym zaznaczeniem struktury (ryc 3) [13, 14]. Dlatego też serotypy tej grupy do dziś nazywa się nefropatogennymi.
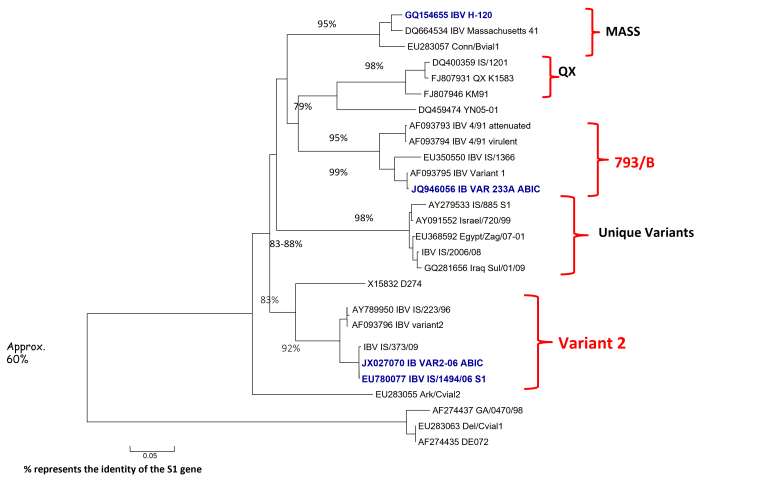
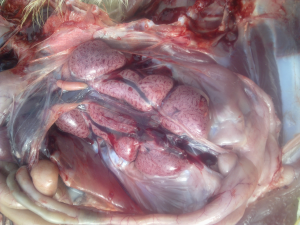
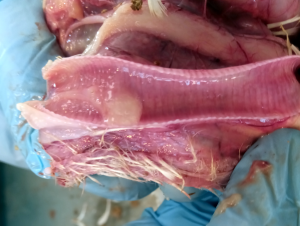
Od około roku 2003 w Chinach zaobserwowano obecność nowego serotypu, zaklasyfikowanego do grupy GI-19, znanego pod nazwą QX lub D388. Wirus ten, był przede wszystkim przyczyną patologii w obrębie układów rozrodczego i wydalniczego. Krótko po ukazaniu się pierwszego raportu, inni badacze opisali cyrkulację tych nefropatogennych szczepów podobnych do QX na terenie Bliskiego Wschodu, Europy i Afryki [15]. Wirus QX izolowany z powodzeniem z nerek, jajowodu i migdałków jelit ślepych był podejrzany o spowodowanie u kurek trwałych uszkodzeń jajowodu we wczesnym okresie odchowu (tzw. „fałszywe nioski”). Ptaki te wskutek przechorowania cierpiały na nieodwracalne zmiany w układzie rozrodczym (Fot 4 i 5). U brojlerów zakażonych wariantowym szczepem dochodzi najczęściej do upośledzenia funkcji wydalniczych nerek, stąd najbardziej widocznym objawem w kurniku jest tzw. syndrom mokrej ściółki, a w rezultacie słabe wyniki produkcyjne i podniesiona śmiertelność [16].

Zdj. 4 „Fałszywa nioska” – charakterystyczna
Zdj. 5 „Fałszywa nioska” – charakterystyczna postawa „pingwina” cysta jajowodu
W latach na początku XXI wieku na terenie Izraela i krajów przyległych ekonomiczne straty zaczął powodować nowy serotyp IBV, należący do genetycznej grupy GI-23 – IS/1494/06, czyli Var2. Bardzo szybko zakażenie rozprzestrzeniło się w rejonie Turcji, następnie Polski, Ukrainy i Krajów Bałtyckich [17]. Aktualnie w Polsce szacuje się, iż około 30% wszystkich zakażeń IB spowodowanych jest właśnie tym wariantem wirusa (Pic 5-8). U chorych ptaków dość rzadko obserwuje się typowe objawy oddechowe, natomiast w obrazie sekcyjnym widoczne jest silne zapalenie tchawicy z dużą ilością śluzu (ryc. 6), a dominującymi objawami są znaczne uszkodzenie nerek (ryc 7), mokra ściółka, brak przyrostów, szybko postępujące wtórne zakażenia układu oddechowego i w rezultacie znaczna śmiertelność, sięgająca 1-2% dziennie [18]. Zakażone nioski towarowe i rodzicielskie wykazują spadek nieśności nawet do 30%, spadek jakości skorupy (ryc 8), zwiększoną podatność na wirusowe zakażenia towarzyszące (pomimo szczepień –APV, ILT) oraz wtórne zakażenia bakteryjne (Mycoplasma, Ornitobacterium) (Ryc. 9). W odpowiedzi na powstały problem chorobowy została wprowadzona komercyjna szczepionka oparta na homologicznym szczepie Var2 – Tabic Var206.
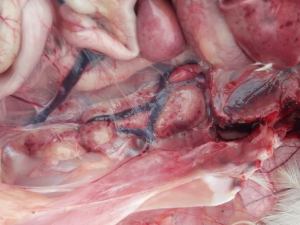
Zdj. 6 IB – zapalenie tchawicy z czopami śluzowymi
Zdj. 7 IB – uszkodzenie nerek

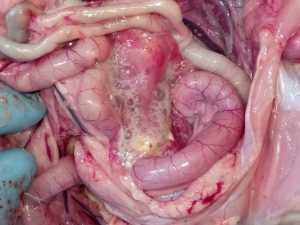
Zdj. 8 Zmiany w skorupach jaj w zakażeniu IB
Zdj. 9 Wtórne zakażenia bakteryjne w przebiegu IB
Profilaktyka
Doświadczenia kliniczne badania laboratoryjne przeprowadzone w latach 90-tych XX wieku między innymi przez Prof. Jane Cook oraz wykazały, że zastosowanie w profilaktyce zakaźnego zapalenia oskrzeli dwóch różnych, atenuowanych, żywych szczepów wirusa IB sprzyja powstawaniu szerokiej odporności skierowanej przeciwko istotnym dla produkcji drobiarskiej, heterologicznym serotypom wirusa IB [1,4,11]. To doprowadziło do powstania idei odporności krzyżowej powstającej po zastosowaniu silnie immunogennych szczepów IBV nie należącymi do tego samego serotypu. U podstaw tego zjawiska leży najprawdopodobniej fakt, że zasadnicza część genomu pozostaje u obu wariantów niezmieniona. Z praktycznego punktu widzenia oznacza to, że optymalną szczepionką w programie profilaktycznym było zastosowanie bazowego szczepu Massachusetts (np. H-120) jednocześnie ze szczepem wariantowym 793B (np. Var233A) [14].
Wraz z biegiem czasu, intensyfikacją produkcji drobiarskiej i odkrywaniem coraz to nowych serotypów wirusa IB o zmiennej patogenności zauważono, że pomimo szczepienia standardowymi szczepami IBV H120 w wielu przypadkach żaden ze stosowanych programów nie dawał pełnej protekcji przed zachorowaniem. Zauważano także brak skutecznej ochrony pomimo zastosowania programów opartych na podstawowym schemacie odporności krzyżowej Mass+793B, co pozwalało sądzić o braku odporności krzyżowej pomiędzy wieloma innymi serotypami [19, 4]. Między innymi w Izraelu, gdzie problem nieskuteczności pojawił się jako jeden z pierwszych, w obliczu zakażeń chińskimi serotypmi IBV, Udi Ashash wraz z grupą badaczy przeprowadził doświadczenie, w którym po zastosowaniu szczepionki TAbic Var (zawierającej serotyp 233A z grupy 793B) oceniono jej protekcję przeciwko niektórym szczepom nefropatogennym. W tym celu grupę 80 piskląt brojlerów (nie SPF!) podzielono na 4 rozmieszczone oddzielnie grupy, po 20 ptaków w każdej. Następnie po wybraniu grup kontrolnych, czyli nie zaszczepionej i zakażonej oraz nie zaszczepionej i nie zakażonej (grupy 1 i 2) dwie z nich zaszczepiono donosowo odpowiednio w grupie 3 szczepionką Abic H120 w grupie nr 4 szczepionką Tabic Var. Następnie w obu grupach dokonano powtórnego szczepienia w wielu 14 dni przy użyciu szczepionki Tabic Var podanej donosowo. Następnie grupy nr 2,3 i 4 zakażono w wieku 35 dni zakażono chińskim szczepem nefropatogennym YN05-1. Przez 7 dni po zakażeniu obserwowano u ptaków występowanie objawów klinicznych oraz śmiertelność. Ptaki padłe poddawano badaniu sekcyjnemu sprawdzając zmiany anatomopatologiczne. Po zakończeniu doświadczenia w wieku 42 dni u pozostałych ptaków dokonano badanie sekcyjne oraz test ciliostazy, który faktycznie oddaje status układu oddechowego po szczepieniu i/lub zakażeniu.
Po szczegółowej analizie uzyskanych wyników stwierdzono, że brojlery które zostały dwukrotnie zaszczepione szczepionką zawierającą szczep 233A z rodziny 793B (grupa ptaków nr 4) po zakażeniu kontrolnym chińskim serotypem wariantowym nie wykazywały żadnych objawów klinicznych ani zmian anatomopatologicznych związanych z IB [14]. W rezultacie można stwierdzić, że zastosowany program profilaktyczny okazał się w pełni skuteczny. W przypadku ptaków z grupy nr 3, czyli zaszczepionych kombinacyjnie szczepionkami zawierającymi najpierw szczep IBV H120, a następnie 793B protekcja była nieco słabsza, choć również zadowalająca i sięgnęła 75%. W grupie nr 2, która nie została poddana szczepieniu śmiertelność sięgnęła 100%. Wyniki przeprowadzonego doświadczenia zgrupowano w tabeli 1.
Tabela 1. Zabezpieczenie przed zakażeniem chińskimi serotypami IBV przy użyciu szczepionki TAbic IB Var®
| Grupa | Liczba ptaków | Program szczepień | Obj. klin / Zmiany anatomo-patolog. | Śmiertelność | % zakażonych |
| 1 | 20 | Kontrola: nie szczepione – nie zakażone | none | 0 | 0% |
| 2 | 20 | Kontrola: nie szczepione – zakażone | 6/20 | 6/20 | 60% |
| 3 | 20 | H120+TAbic IB Var | 3/20 | 2/20 | 25% |
| 4 | 20 | Tabic IB Var+ TAbic IB Var | 1/20 | 0/20 | 5% |
Reasumując, na podstawie tego doświadczenia oraz późniejszych doniesień terenowych można stwierdzić, że dwukrotne podanie szczepionki Tabic Var zapewnia wysoką skuteczność w ochronie ptaków przed zakażeniem wieloma szczepami wariantowymi wirusa IB.
Niestety w roku 2006 na terenie Izraela odnotowano nową falę zakażeń wirusem IB. Choroba głównie dotyczyła stad brojlerów i bardzo szybko rozprzestrzeniła się na pozostałe kraje Bliskiego Wschodu. Monitoring i analiza molekularna wirusa wykazała, że za zakażenie odpowiedzialny jest nowy serotyp IS 1496/06, który nazwany został w skrócie Var2 [20].
Ponieważ dotychczas stosowane programy profilaktyczne okazały się mało efektywne w obliczu zakażeń nowym serotypem, bardzo szybko, bo już w 2009 roku wprowadzono wysoce skuteczną szczepionkę zawierającą homologiczny atenuowany szczep wirusa Var2. Kilkuletnie intensywne stosowanie tej szczepionki doprowadziło do znacznego ograniczenia klinicznych przypadków choroby. Epizootia następowała wiele szybciej niż procesy rejestracyjne szczepionki w sąsiednich krajach, czasem także z powodów politycznych. Toteż pomimo szerokiej i różnorodnej profilaktyki terenowa odmiana tego wirusa była wkrótce obecna w Turcji, a stamtąd szybko migrowała do Europy Środkowej i Wschodniej. Aktualnie wg lokalnych doniesień w Polsce, która jest największym producentem mięsa drobiowego w krajach Unii Europejskiej odsetek zakażeń izraelskim wariantem wirusa IB Var2 wynosi ponad 40% wszystkich klinicznych przypadków zakaźnego zapalenia oskrzeli. Co ważne, choroba dotknęła już nie tyko stada brojlerów, ale coraz częściej jest obserwowana w stadach niosek towarowych i reprodukcyjnych [21]. U chorych brojlerów najczęściej rozróżnia się 2 typy przebiegu choroby. Pierwszy, tzw. zakażenia wczesne, do których dochodzi już w pierwszym tygodniu życia obserwuje się bardzo szybkie różnicowanie stada, uporczywą biegunkę, zwiększoną śmiertelność nawet do 1-2% dziennie, a szybko pojawiającą się kulawiznę poprzedzają powikłania wtórnych zakażeń bakteryjnych wywoływanych głównie przez Ornitobacterium, E.coli i Mycoplasma sp. Szczyt upadków przypada na około 10-16 dzień życia, zwykle później śmiertelność obniża się i stabilizuje na podniesionym w stosunku do normy poziomie i trwa do końca produkcji. Drugi typ przebiegu choroby jest związany z późnymi zakażeniami wirusem Var2. W tym przypadku zwykle bez objawów klinicznych poprzedzających szczyt śmiertelności (2-4% dziennie) przypadający około 29-32 dnia życia. I chociaż w kilku przypadkach odnotowano bardzo słabo zaznaczone objawy oddechowe, podobnie jak w pierwszym przypadku dominują bardzo szybko rozwijające się wtórne zakażenia bakteryjne. Po kilku dniach choroby śmiertelność w stadzie spada do normy to jednak stado aż do wieku uboju nie osiąga pożądanych parametrów wydajności. W obu przypadkach przebiegu choroby podczas sekcji obserwuje się przede wszystkim głęboką nefropatię, bakteryjne zakażenie dolnych części układu oddechowego oraz silne zapalenie tchawicy, z włóknikowo-śluzowatymi złogami, pomimo, że w obrazie klinicznym stada objawy oddechowe jak kichanie, kaszel czy duszność występują sporadycznie [2].
U ptaków długo żyjących tj. niosek towarowych i reprodukcyjnych dominujące objawy kliniczne to spadek nieśności, pogorszenie jakości skorupy, spadek parametrów wylęgowości i lekkie objawy oddechowe. Wśród objawów sekcyjnych dominuje nephritis, wtórne zakażenia bakteryjne oraz cysty jajowodowe, które zwykle są mniejsze niż te związane ze znanymi zakażeniami wariantem chińskim QX. Zakażenie IB w takich stadach ma charakter nawracający, tj. po przechorowaniu i po spadku nieśności rzędu 10-30% sytuacja powraca do normy, jednakże ponownie podobne objawy pojawiają się 6-12 tygodni po pierwszym zakażeniu [22].
Dość często stosowane programy profilaktyczne przeciwko IB nie zabezpieczają skutecznie ptaków długo żyjących na okres produkcji, toteż w krajach Unii Europejskiej, w tym w Polsce, stało się standardem doszczepianie w okresie produkcji, szczepionkami żywymi, naprzemiennie stosując 2-3 serotypy wirusa IB co 4-8 tygodni.
Do niedawna sytuacja wydawała się być opanowana, gdyż z powszechnie przyjętą zasadą, że po izolacji konkretnego serotypu z ogniska choroby najlepiej jest zastosować szczepionkę zawierającą homologiczny szczep wirusa [23]. Osobny temat stanowią przypadki, gdy izolowany serotyp terenowy nie posiadał swojego odpowiednika szczepionkowego. W takich przypadkach zakażeń heterologicznych stosowano dwa różne serotypy uzyskując zadowalający stopień odporności krzyżowej. Jednakże w ostatnim czasie coraz częściej zaczęto diagnozować zakażenie więcej niż jednym serotypem terenowym na pojedynczych fermach i pomimo szerokich programów profilaktyki p/IB w stadach tych notuje się wysokie straty ekonomiczne [24].
Zdjęcia satelitarne ferm drobiu o różnym profilu produkcji, obrazujące przypadki wieloserotypowych zakażeń terenowymi szczepami IBV.
Zdj. 10 Ferma wielowiekowa (wiek 37, 53 i 80 tyg.) nioski towarowej Lohmann Brown. Pomimo zastosowania programu profilaktycznego opartego o szczepionki zawierające serotypy Mass+D274+793B+QX+M41 (inac) zaobserwowano identyczne objawy kliniczne we wszystkich kurnikach (spadek nieśności, wzrost śmiertelności, zmiany w skorupie jaj), a metodą PCR wykryto serotypy terenowe Var2 (IS1494/06), QX oraz 793B. Kurniki, w których wykryto poszczególne serotypy opatrzono odpowiednimi opisami.

Zdj. 11 Ferma jednowiekowa brojlerów Cobb 500 (wiek 42 dni). Po zastosowaniu programu profilaktycznego opartego o żywe szczepionki zawierające serotypy Mass+D274+793B zaobserwowano identyczne objawy kliniczne we wszystkich kurnikach (wzrost śmiertelności, objawy oddechowe, nepritis i wtórne zakażenia bakteryjne), a metodą PCR wykryto serotypy terenowe Var2 (IS1494/06) i QX. Kurniki, w których wykryto poszczególne serotypy opatrzono odpowiednimi opisami.

Zdj. 12 Ferma wielowiekowa (wiek 27, 39 i 55 tyg.) nioski reprodukcyjnej Ross 308. Pomimo zastosowania programu profilaktycznego opartego o szczepionki zawierające serotypy Mass+D274+793B+QX+M41 (inac) zaobserwowano identyczne objawy kliniczne we wszystkich kurnikach (spadek nieśności, wzrost śmiertelności, zapalenie steku, u kogutów orchitis, u kurek cysty jajowodowe i obniżenie wylęgowości), a metodą PCR wykryto serotypy terenowe NGA 2882006 oraz Kor344/09 i Kor344/08.

Ponieważ stosowanie więcej niż 2-3 szczepionek p/IB ze względów epizootycznych zwykle nie jest zalecane oraz jest rozwiązaniem znacznie obciążającym ekonomicznie, rozpoczęto poszukiwania tańszych kombinacji szczepionek przeciwko IB, które przy minimalnej ilości zastosowanych szczepionek dadzą najszersze spektrum odporności [25, 4, 13]. Z pomocą terenowym lekarzom weterynarii, którzy w takich przypadkach zaczęli stosować różne programy profilaktyczne przyszły badania firmy Phibro (dawniej Abic).
Przeprowadzono niezależnie doświadczenia w Republice Południowej Afryki oraz Rosji, gdzie pisklęta brojlerów podzielono na kilka grup doświadczalnych, a następnie po oddzieleniu grup kontrolnych (szczepione – zakażone oraz nie szczepione – nie zakażone) poddawano je najpierw: w jednej grupie szczepieniu donosowo w wieku 1 dzień szczepionką Tabic Var (793B) a następnie Tabic Var206 w wieku 13 dni, zaś w drugiej grupie Tabic Var dwukrotnie w 1 i 13 dniu życia. Następnie ptaki z obu grup podzielono na 2 podgrupy, które w wieku 33 dni zakażano – jedne szczepem wirulentnym 793B a drugie wirulentnym QX. Padłe ptaki poddawano ocenie sekcyjnej, zaś w wieku 42 dni wszystkie ptaki poddano badaniu testem ciliostazy. W świetle otrzymanych wyników stwierdzono, że zastosowanie podwójnego szczepienia szczepionką Tabic Var206 daje najlepsze rezultaty protekcji krzyżowej przeciwko zakażeniom serotypami QX (75-100%) oraz 793B (79-89%) utrzymując równocześnie sięgające 100% zabezpieczenie przeciwko zakażeniom homologicznym serotypem terenowym Var2 (IS1494/06).
Szczegółowe wyniki przeprowadzonych badań zamieszczono w tabeli 2.
Tabela 2. Poziom zabezpieczenia (%) po zakażeniu eksperymentalnym terenowymi szczepami wirusa IB– doświadczenie w Republice Południowej Afryki oraz Rosji
| Grupa | Szczepienie (gruba kropla) | Zakażenie szczepem | Poziom zabezpieczenia | |
| Doświadczenie w RPA | Doświadczenie w Rosji | |||
| 1 | TAbic IB VAR206®, 1d &13d | 793B | 90% | 94% |
| 2 | QX | 79% | 100% | |
| 3 | 1d TAbic IB-VAR, 13d TAbic IB VAR206® | 793B | 79% | 89% |
| 4 | QX | 75% | 100% | |
| 5 | nie szczepione – zakażone | 793B | 0% | 0% |
| 6 | QX | 0% | 5% | |
| 7 | nie szczepione – nie zakażone | N/A | 100% | 100% |
Zaawansowane badania terenowe nad serotypem Var2 (IS1496/06) i jego odpornością krzyżową wykazały, że żaden inny z obecnych na rynku szczepów szczepionkowych nie jest w stanie zapewnić tak szerokiej, krzyżowej odporności na infekcje znanymi obecnie szczepami wariantowymi wirusa IB. Szczepionka została sprawdzona w Izraelu, Turcji oraz wielu krajach Europy Środkowej, a najlepiej chyba na terenie Polski. Udokumentowane kilkuletnie stosowanie tej szczepionki, także w okresie nieśności potwierdza, że jest ona bezpieczna, a stosować ją można od pierwszego dnia życia ptaków. Dodatkową zaletą produktów TAbic jest ich nowatorska postać liofilizowanej, zabarwionej tabletki, która jest łatwa i bezpieczna w stosowaniu.
Szczepionka Tabic Var206 bez obaw może być stosowana w przypadkach, gdy zostały zdiagnozowane lub nawet gdy podejrzewamy wieloserotypowe zakażenie wirusami IB.
Aktualnie firma Phibro bazując na zdobytym doświadczeniu proponuje następujące schematy szczepienia przeciwko IB (tab. 3, 4, 5).
Tabela 3. Zalecany program szczepień dla niosek towarowych i reprodukcyjnych
| Wiek ptaków | Szczepionka | Droga podania |
| 1 dzień | TAbic Var 206 | spray gruba kropla |
| 2 tyg. | TAbic Var 206 | spray gruba kropla |
| 5 tyg | TAbic Var (793B) | spray gruba lub drobna kropla |
| 9 tyg. | TAbic Var 206 | spray gruba lub drobna kropla |
| 14-16 tyg. nioska towarowa | szczepionka inaktywowana IB (szczep M41) | iniekcja |
| 16-18 tyg. nioska reprodukcyjna |
Tabela 4. Zalecany program szczepień dla kurcząt brojlerów
| Wiek ptaków | Szczepionka | Droga podania |
| 1 dzień | TAbic Var 206 | spray gruba kropla |
| 2 tyg | TAbic Var 206 | spray gruba kropla |
Tabela 5. Alternatywny zalecany program szczepień dla kurcząt brojlerów
| Wiek ptaków | Szczepionka | Droga podania |
| 1 dzień | TAbic Var206 | spray gruba kropla |
| 2 tyg. | TAbic Var (793B) | spray gruba kropla |
W związku z coraz powszechniej pojawiającymi się na świecie, zróżnicowanymi antygenowo szczepami wirusa IB, skonstruowanie dobrego programu profilaktycznego kontrolowania zakażeń IB staje się bardzo trudne. Jednocześnie, nie wydaje się możliwe ani pożądane konstruowanie coraz to nowych, żywych i atenuowanych szczepionek przeciwko zakażeniu każdym kolejnym serotypem pojawiającym się w terenie.
Wyniki wspomnianych badań potwierdzają, że koncepcja wdrażania programów profilaktycznych zapewniających szeroką odporność krzyżową jest praktyczna i słuszna. Odporność uzyskiwana w warunkach terenowych jest zadowalająca, a efekt ekonomiczny w pełni uzasadnia wydatek na dodatkowe szczepienie.
Obecnie, chociaż wydaje się, że proponowane coraz to nowsze metody diagnostyki oraz coraz doskonalsze programy profilaktyczne pozwalają w wielu przypadkach skutecznie kontrolować zakażenia IB, to należy jednak mieć świadomość, jak bardzo nieprzewidywalny jest sam wirus IB i jak wiele informacji o nim wciąż pozostaje do odkrycia.
Powyższy artykuł został opublikowany w numerze I. 2021 „Życie Weterynaryjne”
Piśmiennictwo
- Cook, J.K.A. 2008.Coronaviridae. In: Poultry Diseases, 6th Pattison, M., McMullin, P.F., Bradbury, J.M., Alexander, D.J. (Eds). Elsevier, London. pp. 340-349.
- Domańska-Blicharz, K. 2018. Zakaźne zapalenie oskrzeli kur – ogólnoświatowy problem w przemyśle drobiarskim. Życie Weterynaryjne 93(6). pp. 384-387
- Cavanagh D., et all. 2003. In Diseases of poultry. 11th pp.101-121
- Cook, J.K.A., Jackwood, M., Jones, R.C. 2012. The long view: 40 years of infectious bronchitis research. Avian Pathol. 41, 239-250.
- Charlton, B.R., et all, 2006. Avian disease manual 6th pp.46-49
- Domańska-Blicharz, K., Śmietanka, K., Minta, Z. 2007. Molecular studies on infectious bronchitis virus isolated in Poland. Bull Vet Inst Puławy 51, 449-452.
- de Wit, JJ., Cook, J.K.A. 2014. Factors influencing the outcome of infectious bronchitis vaccination and challenge experiments. Avian Pathol.43,485-497.
- Gallardo R.A. et al 2011. Infectious bronchitis virus in testicles and veneral transmission. Avian Diseases 55, 255-258
- Cook, J.K.A. 2015 Infectious Bronchitis – pathotypes and protectotypes; what is the current situation? Proceedings of XIX WVPA Congress, Capetown.
- de Wit, J.J. 2000. Detection of infectious bronchitis. Technical Review. Avian Pathol. 29, 71-93.
- de Wit, J.J., Cook, J.K.A., van der Heijden, H.M.J.F. 2011. Infectious bronchitis virus variants: a review of the history, current situation and control measures. Avian Pathol.40,223-235.
- Valastro V. et al. 2016. S1 gene-based phylogeny of infectious bronchitis virus: an attempt to harmonize virus classification. Infection, Genetics and Evolution, 39, 349-364
- Krupa M. 2020 Zakaźne zapalenie oskrzeli kur – ciągle problem. Polskie Drobiarstwo, Suplement Zdrowie 2020, pp.73-77
- Pijarska-Bińkowska, I., Stępień, M. 2015. Zakaźne zapalenie oskrzeli kur – problem ciągle aktualny. Zastosowanie wariantowego izolatu 233A do profilaktyki IB. Polskie Drobiarstwo Suplement Zdrowie 2015. pp.11-12
- Stooker, L. et al. QX remains most prominent IBV strain in Europe, Africa and Middle East. 2014. 8th Symposium on ACOV &V, Rauischholzhausen, Germany 2014
- Kiss, I., et all. 2015. Survey indicates circulation of 4/91 and QX type infectious bronchitis viruses in Hungary in 2014-short communication. Acta Veter Hungarica 63 (3). pp. 382-388
- Lisowska, A., Domańska-Blicharz, K., 2016. Pierwsze w Polsce przypadki bliskowschodniego wariantu Var2 wirusa zakaźnego zapalenia oskrzeli kur. Polskie Drobiarstwo Suplement Zdrowie 2016. pp.19-24
- Lisowska, A., Sajewicz-Krukowska, J., Fusaro, A., Pikula, A., Domańska-Blicharz, K. First characterization of a Middle East GI-23 lineage (Var2-like) of infectious bronchitis virus in Europe. Vir. Research, vol 241, pp. 43-48
- Terregino, C., et al. 2008. Pathogenicity of a QX strain of infectious bronchitis virus in specific pathogen free and commercial broiler chickens, and evaluation of protection induced by a vaccination programme based on the Ma5 and 4/91 serotypes. Avian Pathology, Oct 2008 37(5). pp. 487-493
- Even-Chen T., Perelman B., Hodorowicz W., Ashash E.,2019 Epidemiology and spreading of a dominant Infectious Bronchitis Virus (IS/1494/06). Proceedings of 21st International WVPA Congress, Bangkok 2019, pp.318-319
- Lisowska A., et al 2016.Detection of middle East IBV Var2 in broilers in Poland. Proceedings of 9th International symposium on Corona and Pneumo viruses. pp. 104.
- Jackwood, M.W., de Wit, J.J. 2013.Infectious Bronchitis. In: Swayne, D.E., Glisson, J.R. McDougald, L.R., Nolan, L.K., Suarez, D.L., Nair, V. L. (Eds). Diseases of Poultry, 13th John Wiley & Sons, Inc. pp.139-159.
- 2012.Proceedings of 7th International Symposium on avian corona- and pneumoviruses and complicating pathogens, Rauischholzhausen, Germany.M. Lierz, U. Heffels-Redmann, E.F. Kaleta, J. Heckmann (Eds).
- Hodorowicz W., Ashash E. 2019. IB field cases – Co-circulation of IBV field strains in Central and Eastern Europe. Proceedings of 21st International WVPA Congress, Bangkok 2019, pp.314-315
- 2014.Proceedings of 8thInternational Symposium on avian corona- and pneumoviruses and complicating pathogens, Rauischholzhausen. Germany. M. Lierz, U. Heffels-Redmann, D. Enderlein (Eds).